你知道吗?在人类历史的长河中,有一种元素默默无闻地扮演着重要的角色,它既不像黄金那样耀眼夺目,也不像铁那样坚韧无比,然而,它却以其独特的性质和广泛的应用领域,成为了现代社会不可或缺的一部分。它就是锡元素。
锡元素,化学符号为Sn,是一种具有银白色金属光泽的元素,它的存在可以追溯到几千年前的古代文明。早在古埃及时期,人们就开始使用锡来制作各种工艺品和装饰品,展示出了锡元素的独特魅力。
让我们一起深入探索锡元素的奥秘,了解它在不同领域的应用,以及它对人类社会的重要意义。锡元素,一个看似平凡却又不可或缺的存在,正以其独特的魅力和广泛的用途,为我们的世界增添着无限的色彩。

1. 电子和信息技术:锡元素在电子和信息技术领域扮演着重要角色。首先,锡合金常用于制造焊锡,用于电子元件的连接和电路板的制造。其次,锡也被广泛应用于电子封装材料中,如焊锡膏和封装胶。此外,锡合金还用于制造电子器件的外壳和连接器。锡元素的良好导电性和耐腐蚀性使其成为电子和信息技术领域不可或缺的材料。
2. 食品包装:锡元素在食品包装领域有重要应用。由于锡合金具有良好的耐腐蚀性和密封性,常用于制造食品罐头。食品罐头中的锡层可以有效地保护食品免受氧气和湿气的侵蚀,延长食品的保质期。此外,锡合金还用于制造饮料罐、罐盖和食品容器等。
3. 建筑和装饰:锡元素在建筑和装饰领域也有广泛应用。锡合金常用于制造屋顶、墙板和管道等建筑材料,因为它具有良好的耐腐蚀性和耐候性。此外,锡合金还用于制造装饰品、钟表和金属工艺品等,展示出锡元素独特的金属光泽和可塑性。
4. 化工和冶金:锡元素在化工和冶金领域有重要应用。锡化合物常用于制备化学试剂和催化剂,用于合成有机化合物和促进化学反应。此外,锡还用于电镀工艺中,用于制造具有耐腐蚀性和装饰性的金属涂层。在冶金领域,锡合金常用于制造合金材料,如青铜和白铜,以提高材料的强度和耐腐蚀性。
5. 医药和生物技术:锡元素在医药和生物技术领域也有重要应用。锡化合物被广泛应用于医药领域,用于制备药物和治疗疾病。锡元素还用于生物学研究中,如细胞培养和基因工程等领域。
除了以上几个领域,锡元素还在汽车工业、航空航天、能源和环境保护等领域有应用。总的来说,锡元素以其独特的性质和广泛的应用领域,为现代社会的发展做出了巨大贡献。

锡元素是一种具有特殊物理性质的金属元素,下面详细介绍它的物理性质:
1. 外观和光泽:锡元素呈银白色,具有金属光泽。它的表面光滑,反射能力强,给人一种亮丽的视觉效果。
2. 熔点和沸点:锡元素的熔点为231.89℃,沸点为2260℃。相比于其他金属元素,锡的熔点相对较低,使其在加热时更容易熔化和处理。
3. 密度:锡元素的密度为7.3克/立方厘米。它的密度较大,使得锡具有一定的重量感,适合用于制造一些需要稳定性和重量的产品。
4. 导电性:锡元素具有良好的导电性。它是一种优良的导电金属,可以有效地传导电流,因此在电子和电气领域有广泛的应用。
5. 热传导性:锡元素具有良好的热传导性。它能够迅速传导热量,使其在热传导和散热方面有一定的优势。
6. 延展性:锡元素在适当的温度下具有良好的延展性。在100℃左右,锡可以被展开成极薄的锡箔,非常柔软和可塑。
7. 磁性:锡元素是一种非磁性金属,不受磁场的吸引和影响。这使得锡在一些特殊的应用中具有优势,例如电子设备中需要避免磁场干扰的场合。
8. 热膨胀系数:锡元素的热膨胀系数较大,即在温度变化时,其体积会发生较大的变化。这一特性使得锡在一些需要考虑热膨胀和收缩的应用中具有重要作用。
锡元素以其特殊的物理性质,如低熔点、良好的导电性和延展性等,成为了许多领域中不可或缺的材料。它的独特性质使得锡在电子、建筑、化工、医药等领域有广泛的应用。

锡元素的化学性质相对稳定,下面详细介绍它的化学性质:
1. 氧化性:锡元素在常温下相对稳定,不易被氧气氧化。这使得锡能够保持其银白色的光泽,不易生锈和腐蚀。
2. 化合价:锡元素的化合价可以是二价或四价。在化合物中,锡通常以Sn(II)或Sn(IV)的形式存在。这使得锡能够形成多种不同的化合物,具有丰富的化学反应性。
3. 酸性:锡元素在常温下不溶于酸,但在浓酸中会被逐渐溶解。浓硝酸和浓硫酸能够与锡反应,生成相应的锡盐。
4. 还原性:锡元素具有一定的还原性,可以参与许多还原反应。例如,锡可以将二价铁离子还原为铁金属,还可以将硝酸银溶液中的银离子还原为银金属。
5. 与硫化物的反应:锡元素与硫化物反应形成硫化锡。硫化锡是一种重要的锡矿石,在冶金和化工领域有广泛应用。
6. 与卤素的反应:锡元素可以与卤素(氯、溴、碘)反应,形成相应的卤化物。锡的卤化物在有机合成和化学分析中有重要应用。
7. 与氧化剂的反应:锡元素可以与氧化剂反应,被氧化为锡的高价态。例如,锡可以被硝酸铅氧化为四价锡,或被过氧化氢氧化为二价锡。
锡元素的化学性质相对稳定,不易被氧化和腐蚀。它可以形成多种化合物,参与各种化学反应,具有广泛的应用价值。锡的化学性质使其在电子、化工、医药等领域有重要的应用。

锡元素在生物体内的生物特性相对较少研究,但以下是一些关于锡元素的生物特性的详细介绍:
1. 生物可利用性:锡元素在自然界中以无机形式存在,主要以锡离子(Sn2+和Sn4+)的形式存在。这些锡离子可以被生物体吸收和利用,但其生物可利用性相对较低。
2. 生物毒性:锡元素在一定浓度下对生物体具有一定的毒性。高浓度的锡离子可以对细胞和组织产生损害,导致细胞死亡和组织损伤。锡的有机化合物,如有机锡化合物(如三丁基锡和三苯基锡等),具有更高的毒性,对生物体的影响更为显著。
3. 生物积累:锡元素在生物体内可以发生积累。锡离子可以通过食物链进入生物体,从而在生物体内逐渐积累。这种积累可能对生物体的健康产生负面影响。
4. 生物转化:锡元素在生物体内可以发生一些化学转化。例如,锡离子可以与硫化物反应形成硫化锡,或与有机物反应形成有机锡化合物。这些转化可能对生物体的代谢和生理功能产生影响。
5. 生物应用:尽管锡元素的生物毒性存在,但在医药和农业领域仍有一些应用。例如,锡化合物可以用作抗菌剂、杀虫剂和杀真菌剂等。此外,锡也被用于一些医疗器械和药物的制备中。
需要注意的是,锡元素的生物特性还存在许多未知和待研究的领域。对于锡元素的生物学效应和生物毒性的深入研究仍然需要进一步的科学探索和实验验证。

锡元素在自然界中以锡矿石的形式存在,以下是关于锡元素在自然界分布状况的详细介绍:
1. 锡矿石:锡元素主要以锡矿石的形式存在于地壳中。最常见的锡矿石是锡石(SnO2),也称为锡石矿。锡石是一种氧化锡矿石,通常呈黑色或棕色。锡石广泛分布于世界各地,主要产地包括中国的云南、马来西亚、印度尼西亚、巴西、泰国等。
2. 其他锡矿石:除了锡石,还有一些其他类型的锡矿石存在。例如,锡黄铁矿(Cu2FeSnS4)是一种含锡的硫化物矿石,常见于铜矿床中。此外,锡还可以以锡铅矿(PbSnSb2S6)和锡锑矿(Cu2FeSnS4)等形式存在。
3. 锡矿石的开采:锡矿石的开采主要通过矿山开采和矿石选矿等方式进行。开采锡矿石的主要目的是提取其中的锡金属,用于工业生产和其他应用。
4. 锡矿石的加工:锡矿石在开采后需要经过一系列的加工步骤,以提取出其中的锡金属。常见的加工方法包括破碎、磨矿、浮选和冶炼等。通过这些加工步骤,可以将锡矿石中的锡含量提高到较高的水平。
5. 锡矿石的利用:提取出的锡金属可以用于制备合金、电子器件、化工产品等。锡合金具有良好的耐腐蚀性和可焊性,常用于制造食品罐、饮料罐、电子元件等。此外,锡金属还可以用于制备锡酸盐、有机锡化合物等化学品。
需要注意的是,锡矿石的分布状况和产量在不同地区和不同时间可能会有所变化。随着科技的进步和资源的开发,新的锡矿床可能会被发现,而一些传统的锡矿床可能会逐渐枯竭。因此,锡矿石的分布状况需要根据具体的地理和经济条件进行考虑。

锡元素的开采和提炼过程通常包括以下几个步骤:
1. 矿石开采:首先需要进行锡矿石的开采。开采方法根据矿床类型和地质条件的不同而有所差异。常见的开采方法包括露天开采和地下开采。露天开采适用于锡矿床较浅且矿石分布广泛的情况,而地下开采适用于锡矿床较深或矿石分布较局部的情况。
2. 矿石破碎和磨矿:开采后的锡矿石通常需要经过破碎和磨矿的步骤。矿石被送入破碎机进行粗破碎,然后经过细破碎,将矿石破碎成较小的颗粒。接下来,矿石颗粒被送入磨矿机进行细磨,以获得所需的矿石粉末。
3. 矿石选矿:磨矿后的矿石粉末通常包含其他杂质,需要进行选矿处理。选矿的目的是通过物理或化学方法分离出锡矿石中的锡金属。常见的选矿方法包括浮选、重选、磁选和电选等。浮选是最常用的选矿方法,通过调整矿石和药剂的性质,使锡矿石中的锡颗粒与气泡结合,从而实现锡的分离和提取。
4. 锡金属的冶炼:选矿后得到的锡矿石精矿通常需要进行冶炼,以提取出锡金属。常见的冶炼方法包括火法冶炼和湿法冶炼。火法冶炼是最常用的方法,将锡矿石精矿与焦炭或煤一起加热,使锡石中的锡氧化物还原为金属锡。湿法冶炼则是通过溶解锡矿石精矿,然后利用化学反应将锡转化为金属锡。
5. 锡金属的精炼:冶炼得到的锡金属通常还需要进行精炼,以提高纯度和去除杂质。常见的精炼方法包括电解精炼和蒸馏精炼。电解精炼是将锡金属作为阳极,通过电解过程将杂质从锡金属中分离出来。蒸馏精炼则是利用锡金属的低沸点,通过蒸馏过程将杂质从锡金属中蒸发出去。
需要注意的是,锡元素的开采和提炼过程可能因矿床类型、矿石性质和工艺技术的不同而有所差异。上述步骤仅为一般性描述,具体的开采和提炼过程可能会有所调整和改进。

锡元素的常用检测方法主要包括原子吸收光谱法(AAS)、电感耦合等离子体质谱法(ICP-MS)、X射线荧光光谱法(XRF)、原子荧光光谱法(AFS)等。
1. 原子吸收光谱法(AAS):AAS是一种常用的定量分析方法,适用于测定溶液中的锡含量。该方法基于样品中目标元素吸收特定波长的光线时的吸收现象。首先,通过气体燃烧、高温干燥等预处理步骤将样品转化为可测量的形式。然后,向样品中通入与目标元素波长相对应的光线,测量样品吸收的光强度,并与已知浓度的锡标准溶液进行比较来计算样品中锡的含量。
2. 电感耦合等离子体质谱法(ICP-MS):ICP-MS是一种高灵敏度的分析技术,适用于测定液体和固体样品中的锡含量。该方法将样品转化为带电粒子,然后使用质谱仪进行质量分析。ICP-MS具有广泛的检测范围和高分辨率,可以同时测定多个元素的含量。对于锡元素的检测,ICP-MS能够提供非常低的检测限和较高的准确性。
3. X射线荧光光谱法(XRF):XRF是一种非破坏性的分析方法,适用于固体和液体样品中的锡含量测定。该方法通过照射样品表面产生的X射线,测量样品中荧光光谱的特征峰强度来确定其中的元素含量。XRF具有速度快、操作简便的优点,并且能够同时测定多个元素。然而,XRF在低含量锡的分析中可能受到干扰而导致误差较大。
4.原子荧光光谱法(AFS):AFS是一种高灵敏度的分析方法,适用于分析液体和气体样品中的锡含量。该方法使用激发源激发样品中的原子,测量样品中发射的特定波长的荧光光强度来确定其中的元素含量。AFS具有高度选择性和极低的检测限,并且可以实现快速分析。
5.电感耦合等离子体发射光谱法(ICP-OES):电感耦合等离子体发射光谱法是一种高灵敏度和高选择性的分析方法,广泛用于多元素分析。它通过将样品雾化并形成等离子体,在光谱仪器中测定铌元素发射的特定波长和强度。
除了以上方法,还有其他常用的锡元素检测方法,包括电化学法、分光光度法等。选择合适的检测方法取决于样品性质、所需测定范围和检测精度等因素,并且常常需要校准标准品进行质量控制,确保测定结果的准确性和可靠性。

在元素测量中,原子吸收法具有较高的准确性和灵敏度,为研究元素的化学性质、化合物组成以及含量提供了有效的手段。
接下来,我们使用原子吸收法来测量锡元素的含量。具体的步骤如下:
制备待测样品。将需要测量的样品制备成溶液,一般需要使用混酸进行消解,以便于后续的测量。
选择合适的原子吸收光谱仪。根据待测样品的性质和需要测量的锡元素含量范围,选择合适的原子吸收光谱仪。
调整原子吸收光谱仪的参数。根据待测元素和仪器型号,调整原子吸收光谱仪的参数,包括光源、原子化器、检测器等。
测量锡元素的吸光度。将待测样品放入原子化器中,通过光源发射特定波长的光辐射,待测锡元素会吸收这些光辐射,产生能级跃迁。通过检测器测量锡元素的吸光度。
计算锡元素的含量。根据吸光度和标准曲线,计算出锡元素的含量。
以下是一款仪器测量锡元素用到的具体参数。

锡(Sn)
标准物:金属锡粒(99.99%)。
方法:准确称取1.000g金属锡,溶于100mL温热的浓HCl中,冷却后用水稀释至1L,此溶液中Sn的浓度为1000μg/mL。避光保存于聚乙烯瓶中。
(1)火焰类型:空气-乙炔,富燃焰。
分析参数:
波长(nm) 286.3
光谱带宽(nm) 0.4
滤波系数 0.3
推荐灯电流(mA) 6.0
负高压(v) 352.75
燃烧头高度(mm) 10
积分时间(S) 3
空气压力及流量(MPa,mL/min) 0.20
乙炔压力及流量(MPa,mL/min) 0.05,3000
线性范围(μg/mL) 5.14~400
线性相关系数 0.999
特征浓度(μg/mL) 6.285
检出限(μg/mL) 1.714
RSD(%) 0.73
计算方式 连续法
溶液酸度 0.5% HNO3
测量表格:
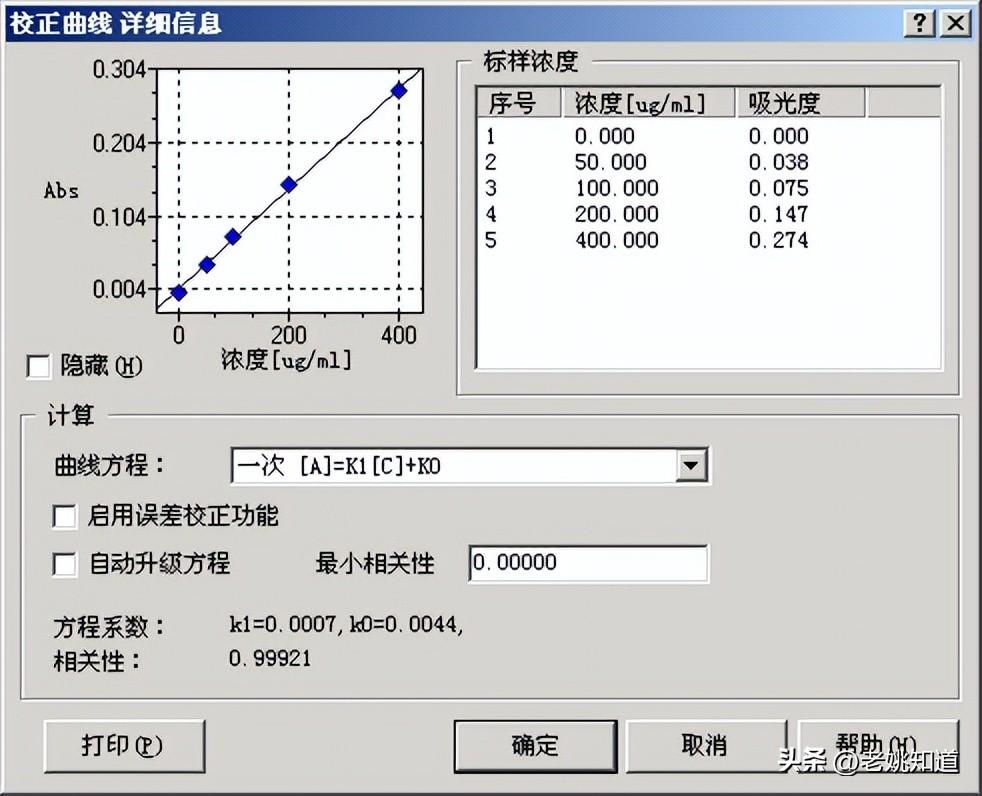
序号 | 测量对象 | 样品编号 | Abs | 浓度 | SD | RSD[%] |
1 | 标准样品 | Sn1 | -0.000 | 0.000 | 0.0004 | -175.9527 |
2 | 标准样品 | Sn2 | 0.038 | 50.000 | 0.0004 | 1.0991 |
3 | 标准样品 | Sn3 | 0.075 | 100.000 | 0.0004 | 0.4685 |
4 | 标准样品 | Sn4 | 0.147 | 200.000 | 0.0011 | 0.7398 |
5 | 标准样品 | Sn5 | 0.274 | 400.000 | 0.0020 | 0.7142 |
校准曲线:
(2)火焰类型:笑气-乙炔,富燃焰。
分析参数:
波长:286.3
光谱带宽(nm) 0.4
滤波系数 0.3
推荐灯电流(mA) 6
负高压(v) 346.0
燃烧头高度(mm)10
积分时间(S) 1
空气压力及流量(MP,mL/min) 0.25,6000
笑气压力及流量(MP,mL/min) 0.22,5000
乙炔压力及流量(MP,mL/min) 0.1,5500
线性相关系数 0.999
特征浓度(μg/mL) 3.667
计算方式 连续法
溶液酸度 0.5% HNO3
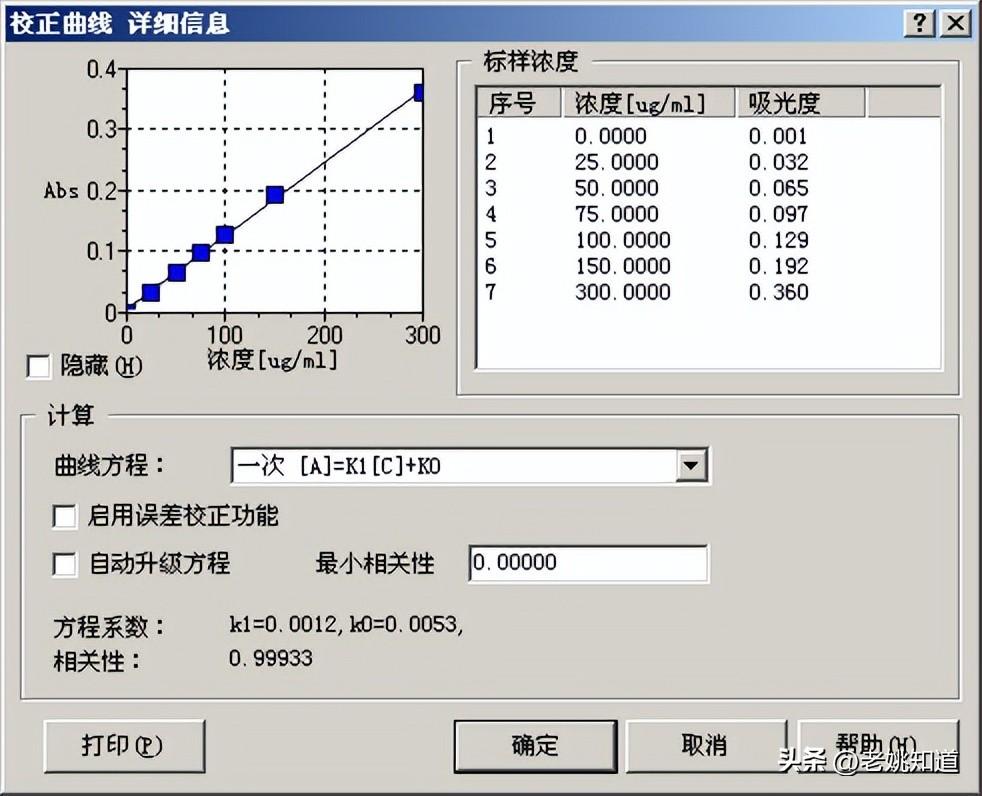
测量表格:
序号 | 测量对象 | 样品编号 | Abs | 浓度 | SD | RSD[%] |
1 | 标准样品 | Sn1 | 0.001 | 0.0000 | 0.0008 | 60.2326 |
2 | 标准样品 | Sn2 | 0.032 | 25.0000 | 0.0005 | 1.5335 |
3 | 标准样品 | Sn3 | 0.065 | 50.0000 | 0.0010 | 1.5712 |
4 | 标准样品 | Sn4 | 0.097 | 75.0000 | 0.0004 | 0.4101 |
5 | 标准样品 | Sn5 | 0.129 | 100.0000 | 0.0004 | 0.2860 |
6 | 标准样品 | Sn6 | 0.192 | 150.0000 | 0.0028 | 1.4373 |
7 | 标准样品 | Sn7 | 0.360 | 300.0000 | 0.0046 | 1.2778 |
校准曲线:
干扰:
空气-乙炔富燃焰灵敏度较高,此时最好选用286.3nm波长,干扰较小。笑气-乙炔火焰中常见干扰可排除。实际分析中,若使用空气-乙炔火焰,应是非常富燃的火焰,PO43-和SO42-有干扰。空气-氢气火焰具有最高的灵敏度,但几乎所有的碱金属、碱土金属,甚至过渡元素以及Al、Ti均有严重干扰。
锡标准系列溶液必须用10%盐酸配制。
实际工作中需要根据现场具体需要选择适合的测量方法。这些方法在实验室和工业中广泛应用于锡元素的分析和检测。